肿瘤微环境(tumor microenvironment, TME)通常伴随着强烈的免疫抑制信号,其中调节性T细胞(regulatory T cells, Tregs)被视为关键抑制因子。Tregs能够通过分泌抑制性细胞因子(如IL-10、TGF-β等)或竞争性结合免疫激活信号等机制,抑制CD8⁺T细胞、NK细胞等效应细胞活性,从而减弱抗肿瘤免疫应答。
在癌症治疗中,许多肿瘤对免疫治疗存在耐受性,其中一个原因即为Treg在肿瘤组织中的浸润和抑制作用强化。因此,选择性去除肿瘤浸润的Treg被认为是提升肿瘤免疫治疗效果的策略之一。虽然“清除Treg”思路在肿瘤免疫研究中早有尝试,但其关键难题在于靶点选择的特异性。传统靶点如CD25、CTLA-4等,往往在效应T细胞或活化T细胞中也有表达,容易诱发自身免疫风险。因此,近年来研究者更加关注那些在肿瘤浸润Treg中高表达但在外周组织中低表达的分子作为更理想靶点。其中,CCR8和TNFR2已逐渐引起关注。CCR8被报道在多种肿瘤的浸润性Treg中富集性表达,并可作为肿瘤特异性Treg的标志之一;而TNFR2在某些Treg亚群中具有重要生存与增殖作用,也是近年来免疫治疗研究的热点之一。因此,设计靶向CCR8与TNFR2的ADC,从而更精准、更强效地清除肿瘤微环境中的Treg,具有重大意义。
2025年9月20日(当地时间),复旦大学基础医学院应天雷/吴艳玲团队、王明伟团队合作在Medicine in Drug Discovery上发表了题为“A bispecific ADC against CCR8 and TNFR2 elicits potent antitumor efficacy”的研究。该研究针对CCR8和TNFR2双靶标设计双特异性ADC,以选择性耗竭肿瘤浸润Tregs,显著提升抗肿瘤免疫效果,结果表明其在小鼠模型中表现出比单靶标ADC更强的抗肿瘤疗效,并实现了部分肿瘤完全消退。

作者设计了4种不同类型的双特异性ADC,在CT26小鼠模型中观察其抗肿瘤效果。结果发现,所有的双特异性ADC都显著抑制肿瘤的生长,其中Bi-4-PBD实现了80%的肿瘤消退,优于单靶点ADC。因此,该结果验证了双特异性ADC的针对实体瘤的治疗潜力(图1)。
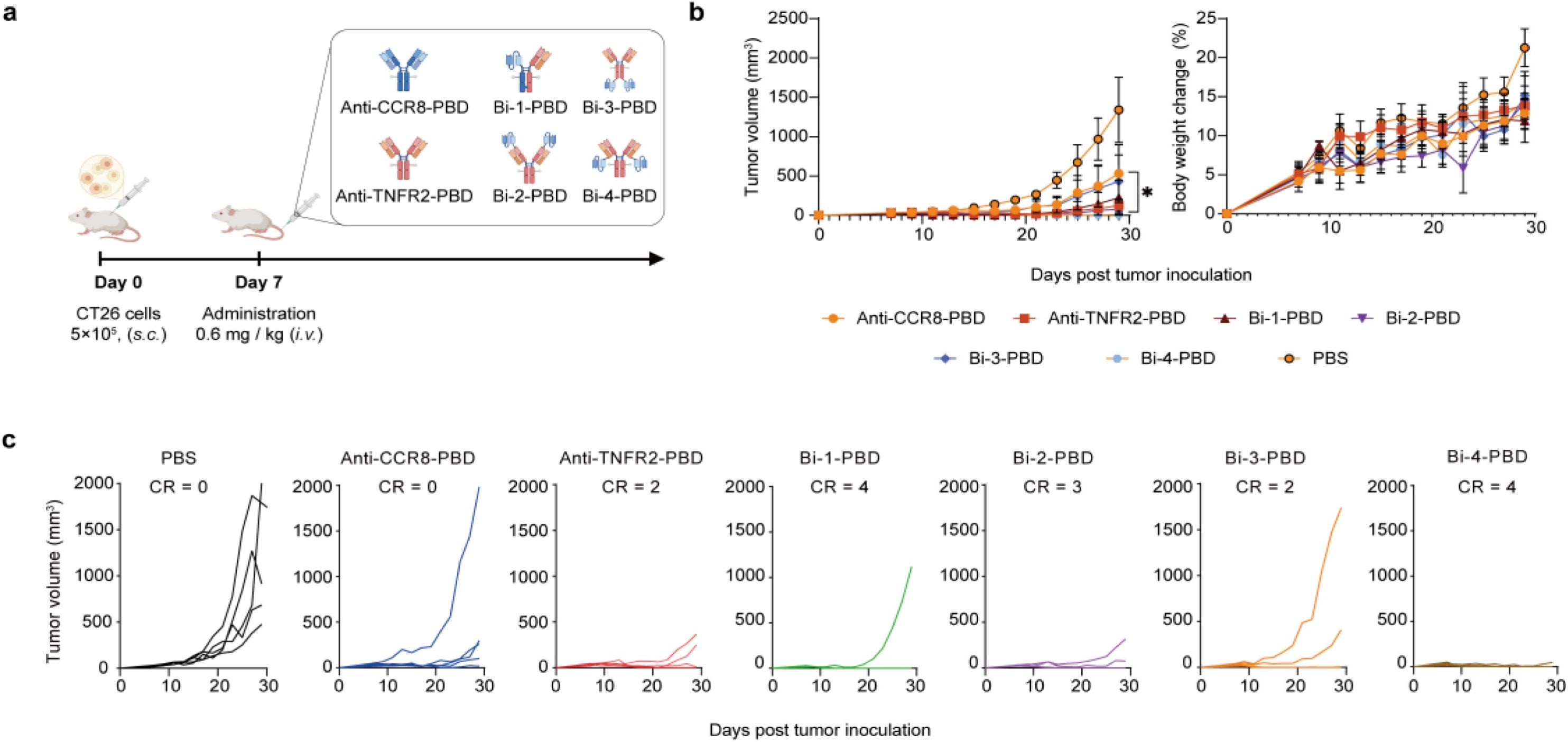
图1 双特异性ADC在小鼠模型中的抗肿瘤效果
综上所述,TME中的Tregs通过抑制效应T细胞功能,成为肿瘤免疫逃逸的核心机制。传统单靶点ADC,如抗CD25-PBD虽能清除Tregs,但存在脱靶毒性风险,且对肿瘤浸润Tregs的选择性不足。近年研究发现,CCR8和TNFR2在肿瘤浸润性Tregs表面共表达,且与Tregs的免疫抑制功能密切相关,为双靶向策略提供了理论依据。该研究为实体瘤免疫治疗提供了新范式,相较于传统疗法在实体瘤中受限于TME抑制性,双特异性ADC通过靶向Tregs特异性标记物,可突破免疫屏障,且双靶点设计降低脱靶风险,为临床转化奠定基础。
复旦大学基础医学院应天雷教授、王明伟教授、吴艳玲研究员为该论文的共同通讯作者,复旦大学基础医学院博士生李温馨、李泉晓博士为该论文的共同第一作者。
注:文中插图源于Medicine in Drug Discovery
相关研究:
