作为“生物导弹” 的抗体药物偶联物(ADCs),凭借精准靶向肿瘤细胞的特性已在癌症治疗中崭露头角,截至2023年8月全球已批准16款ADC药物,另有超100款候选药物进入临床试验。然而,传统ADC多采用分子量约150kDa的IgG 型抗体,在实体瘤治疗中面临肿瘤穿透性差的核心瓶颈——实体瘤组织致密且存在 “结合位点屏障”,IgG型ADC仅能抵达血管周围几层细胞,难以作用于肿瘤深处的癌细胞,同时还存在药物偶联不均一、易在健康器官蓄积等问题,严重限制其临床疗效与安全性。
2024年2月16日(当地时间),上海市重大传染病和生物安全研究院双聘PI、复旦大学基础医学院的应天雷/吴艳玲团队,于期刊Antibody Therapeutics上发表题为“Reforming solid tumor treatment: the emerging potential of smaller format antibody-drug conjugate”的研究,该研究聚焦小分子抗体药物偶联物在实体瘤治疗领域的前沿进展,深入剖析了多种新型小分子抗体格式的研发突破、核心优势及临床转化策略,为下一代精准抗癌药物的开发提供了关键理论指导与技术方向。

为破解这一困境,科研团队将研发重点转向小分子抗体格式,这类抗体片段或模拟抗体的蛋白质支架分子量仅3-80kDa,约为传统IgG的1/20至1/2,不仅具备更强的实体瘤穿透能力,还能结合传统IgG难以识别的隐蔽抗原表位,且药物偶联均一性更优。在众多小分子抗体格式中,单域抗体(sdAb)表现突出,这类仅含重链可变域(分子量12.5-15 kDa)的抗体稳定性高、可塑性强,可灵活整合靶向配体、细胞毒性载荷等功能模块,形成多功能纳米抗体药物偶联物(NDCs)。团队重点介绍了自主研发的全人源单域抗体(UdAb)技术,通过将人源抗体互补决定区(CDRs)嵌入种系IGHV框架区构建全人源单域抗体库,成功开发出靶向癌胚抗原5T4的UdAb n501,其与SN38定点偶联形成的UdADC(n501-SN38)在胰腺癌BxPC-3细胞模型中展现出强效细胞毒性,且在多细胞肿瘤球状体和患者来源的胰腺肿瘤类器官中,穿透能力显著优于传统IgG1型ADC。
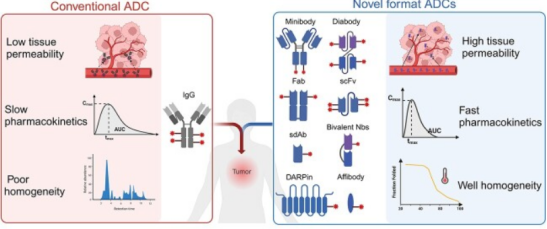
图1 传统ADC与新型格式ADC的特性对比
团队通过肿瘤球状体实验发现,中等亲和力的小分子ADC比高亲和力ADC具有更优的肿瘤穿透性——过高的亲和力会导致药物在肿瘤表面聚集,反而阻碍其向深层组织扩散,因此亲和力需与药物稳定性、溶解度、肿瘤分布等需求平衡,才能实现最佳治疗效果。目前,小分子抗体药物偶联物已在胰腺癌、乳腺癌、小细胞肺癌等多种实体瘤模型中展现出优异疗效,这类小分子偶联物还可拓展至感染性疾病、自身免疫病等领域。
随着半衰期延长、位点特异性偶联等技术的不断成熟,小分子抗体药物偶联物有望成为实体瘤精准治疗的重要突破方向,团队下一步将聚焦“肿瘤微环境响应型连接子”等研发策略,推动药物在抵达肿瘤部位后精准释放有效成分,进一步提升疗效与安全性。
复旦大学基础医学院吴艳玲研究员为该论文的通讯作者,复旦大学基础医学院博士生马小洁为该论文的第一作者。
注:文中插图源于Antibody Therapeutics
相关研究:
