单域抗体偶联药物(sdADC)因分子量远小于传统IgG型抗体偶联药物(ADC),具备更强的实体瘤穿透能力和肿瘤内蓄积能力,在实体瘤治疗领域被寄予厚望。然而,其较短的体内半衰期导致药物在体内易被快速清除,难以维持有效治疗浓度,不仅需要频繁给药,还可能影响临床治疗效果,成为制约其临床应用的核心瓶颈。
2024年4月2日(当地时间),复旦大学基础医学院应天雷/吴艳玲团队在MedComm上发表了题为“Half-life extension of single-domain antibody-drug conjugates by albumin binding moiety enhances antitumor efficacy”的研究。该研究创新性地将抗人血清白蛋白(HSA)纳米抗体与靶向癌胚抗原5T4的全人源单域抗体偶联药物(sdADC)融合,成功解决了单域抗体偶联药物体内半衰期短的关键难题,显著增强了其抗肿瘤疗效,为实体瘤治疗提供了新的策略与方向。

研究人员将自主研发的全人源抗5T4单域抗体n501与抗人血清白蛋白(HSA)纳米抗体通过柔性连接子融合,构建出融合蛋白n501–αHSA,并在特定位点(s224c)与高效细胞毒性药物单甲基奥瑞他汀 E(MMAE)进行定点偶联,最终获得新型单域抗体偶联药物n501–αHSA–MMAE。
实验结果显示,这种融合策略展现出显著优势。在药代动力学研究中,与未结合白蛋白的n501–MMAE相比,n501–αHSA–MMAE在野生型小鼠体内的半衰期延长了10倍,在胰腺癌BxPC-3异种移植肿瘤模型小鼠体内的血清半衰期也延长了5倍,同时药物在小鼠体内的峰浓度(Cmax)显著提升,有效解决了单域抗体药物偶联物“易清除”的问题。
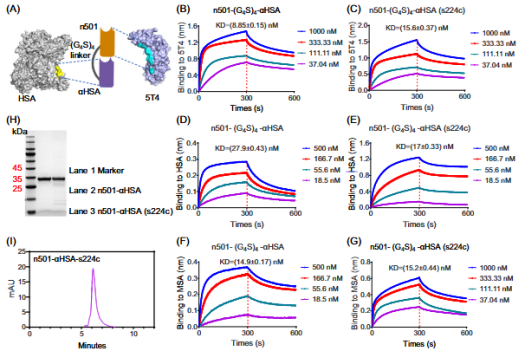
图1.n501–αHSA的设计及其结合特性
更值得关注的是,n501–αHSA–MMAE在肿瘤靶向性和疗效上表现突出。通过近红外荧光成像技术观察发现,该偶联物能有效减少在肝脏、肾脏等正常器官的蓄积,同时显著增强在肿瘤部位的蓄积与滞留能力——给药2小时后即可在肿瘤部位聚集,且24小时后仍能检测到明显信号,肿瘤内药物浓度峰值是n501–MMAE的1.9倍。
在抗肿瘤疗效验证中,n501–αHSA–MMAE展现出优异的治疗效果。在胰腺癌BxPC-3异种移植模型中,其疗效与n501–MMAE相当,能有效抑制肿瘤生长并实现肿瘤消退;而在人卵巢畸胎瘤PA-1异种移植模型中,该偶联物的抗肿瘤efficacy显著优于n501–MMAE,治疗后肿瘤体积和重量均明显小于对照组,且未出现肿瘤复发迹象。
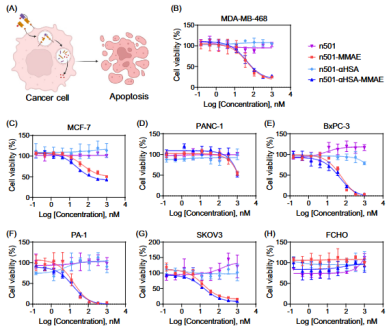
图2. n501–αHSA–MMAE在体外的细胞毒性
安全性评估进一步证实,n501–αHSA–MMAE具有良好的安全性。尽管高剂量下两种偶联物均会产生一定毒性,但n501–αHSA–MMAE对肝脏的毒性显著降低(血清中谷丙转氨酶、谷草转氨酶水平无明显升高),同时肾脏蓄积量也显著减少,在提升疗效的同时降低了毒副作用风险。
该研究首次将白蛋白结合技术应用于单域抗体偶联药物的半衰期延长,证实延长了半衰期的偶联药物有望实现药代动力学、疗效与安全性的协同优化。这种策略不仅为单域抗体偶联药物的开发提供了新范式,也为其他小分子生物制剂的半衰期延长提供了重要参考,有望推动更多高效、安全的靶向抗肿瘤药物进入临床转化阶段。
复旦大学基础医学院应天雷教授、吴艳玲研究员为该论文的共同通讯作者,复旦大学基础医学院李泉晓博士为该论文的第一作者。
注:文中插图源于 MedComm
相关研究:
