双特异性抗体作为下一代抗体疗法的核心方向之一,凭借其独特的双靶点结合机制,在肿瘤、自身免疫性疾病等领域展现出卓越的治疗潜力。自2009年全球首款双特异性抗体药物获批以来,已有十余款产品上市,但传统双特异性抗体因结构设计复杂,普遍面临表达效率低、稳定性不足、治疗效果波动等问题,严重制约了其临床转化与广泛应用。
2025年10月17日(当地时间),复旦大学应天雷/吴艳玲团队和复旦大学附属中山医院杨振霖团队于期刊Antibody Therapeutics发表了题为“Engineering a novel light-chain single-domain antibody to enable IgG-format bispecific antibody design”的文章,该文章通过理性设计与噬菌体展示筛选技术,解决了传统双特异性抗体结构复杂、表达量低、均一性差等关键技术瓶颈,为多靶点协同治疗提供了更稳定、高效的新型解决方案。

团队创新性地提出了轻链工程策略:将驼源重链互补决定区(CDR)与人类κ轻链可变区框架(IGKV3-20)相结合,通过CDR3移植与CDR1/CDR2定点突变的组合技术,成功开发出新型轻链单域抗体VHHL。该设计既保留了人类轻链低聚集性的优势,又通过驼源CDR的高多样性提升了抗原结合亲和力,解决了传统轻链单域抗体亲和力不足、理化性质不均一的难题。
研究团队以小鼠CD16为靶抗原进行验证,通过噬菌体展示库筛选获得了两款高亲和力候选分子L6和L15。结构解析显示,L6晶体结构分辨率达3.05Å,其三个CDR形成独特的共平面钩状构象,能高效识别抗原表位,且与天然人类轻链框架的骨架偏差极小,证实了该工程策略的结构稳定性。这些VHHL分子仍保留了与蛋白L的结合能力,可实现无标签一步纯化,显著降低工业生产成本。

表1. L6的数据收集与精修统计量
在此基础上,团队通过模块化组装与替换两种策略,将VHHL整合到完整IgG抗体结构中,成功构建出新型双特异性抗体。该类抗体不仅在结构上与天然单克隆抗体高度相似,更实现了重链与轻链各自独立的抗原结合功能。实验验证表明,针对人HER2、狂犬病毒(RABV)、肿瘤坏死因子α(hTNF-α)等不同靶点的双特异性抗体,均展现出优异的均一性、稳定性及双靶点结合活性,表达量可达每升数十毫克,远超传统双特异性抗体水平。该平台构建的双特异性抗体采用天然IgG结构,在免疫原性、药代动力学等方面更具临床优势,有望降低免疫相关不良反应风险。
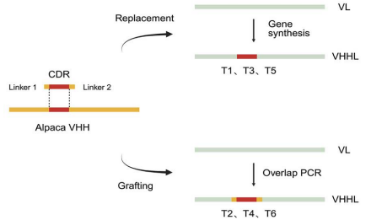
图1. 两种CDR移植策略的示意图
研究首次建立CDR移植与定点突变相结合的轻链单域抗体制备技术;成功解析VHHL的晶体结构,揭示其独特的抗原结合机制;开发两种通用型双特异性抗体构建策略,实现从模块组装到直接替换的灵活应用。这一平台的建立为多功能抗体的开发提供了标准化、高效化的解决方案,有望加速双特异性抗体药物的研发进程,降低生产成本,让更多患者受益于精准靶向治疗。团队后续将进一步拓展靶点范围,推进该平台在肿瘤免疫治疗、抗感染等领域的临床前研究。
复旦大学基础医学院应天雷教授、吴艳玲研究员和复旦大学附属中山医院杨振霖研究员为该论文的共同通讯作者,复旦大学基础医学院王铭锴博士为该论文的第一作者。
注:文中插图源于Antibody Therapeutics
原文链接:https://doi.org/10.1093/abt/tbaf020
